Forskningsgennembrud åbner døren til en helt ny forståelse af det, der udløser allergiske reaktioner.
Lige nu læser andre
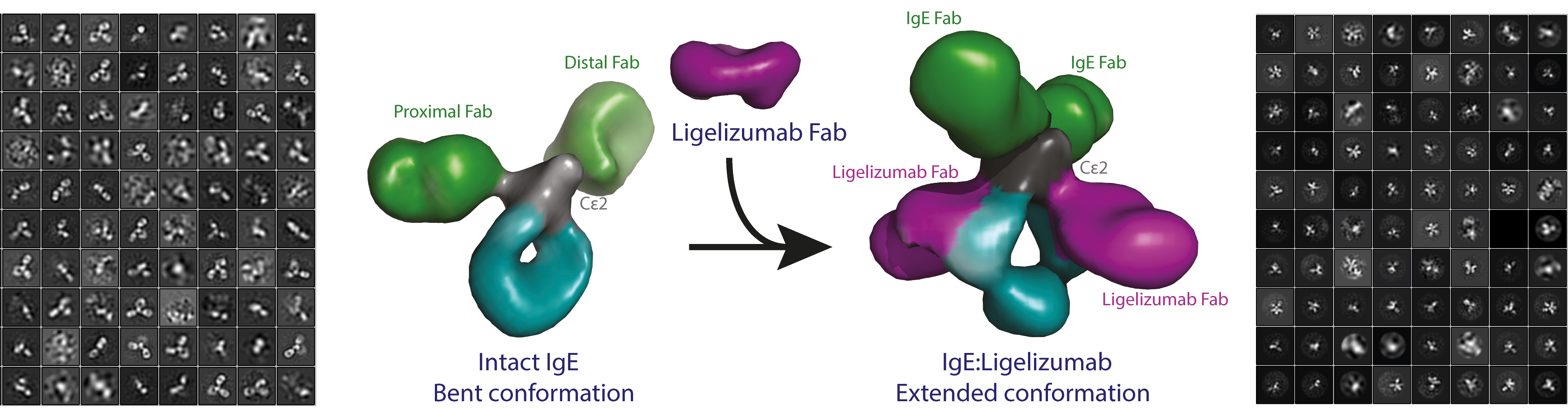
Et internationalt forskerteam har for første gang nogensinde beskrevet den overordnede struktur af et IgE-antistof, som er nøglemolekylet i allergiske sygdomme. Gennembruddet, som er foretaget via elektronmikroskopi, giver vigtig indsigt i allergiske reaktioners grundlæggende mekanismer og kan bane vejen for mere effektiv allergimedicin. Forskningsresultaterne er netop publiceret i det videnskabelige tidsskrift Allergy.
Antistoffer er grundlæggende molekyler i det menneskelige immunsystem. De forskellige typer af antistoffer, der findes i mennesker, deler generelle træk, bl.a. binding til potentielt skadelige antigener samt evnen til at inducere en passende reaktion fra immunsystemet. En fundamental antagelse inden for immunologi siger, at antistoffer er fleksible for at maksimere deres effektivitet.
Et team af forskere fra Aarhus og Marburg, Tyskland, har nu benyttet elektronmikroskopi og små-vinkel røntgenspredning, SAXS (Small-Angle X-ray Scattering) til at beskrive den tredimensionelle struktur af et IgE-antistof. Resultatet var overraskende for de involverede forskere:
”For første gang kunne vi vise, at IgE-antistoffer er unikke og ikke passer med den generelle antagelse om, at antistoffer er fleksible. Mit arbejde med elektronmikroskopi har direkte demonstreret, at IgE er et meget stift molekyle med et veldefineret 3D arrangement af de allergenbindende dele. Herved adskiller IgE sig fra de andre antistof isotyper, vi kender,” forklarer postdoc ved Institut for Molekylærbiologi og Genetik, Aarhus Universitet, Rasmus K Jensen. Rasmus har de sidste to år sammen med sin kollega Michaela Miehe arbejdet intenst på projektet.
Læs også
De to forskere har ligeledes analyseret den strukturelle og funktionelle virkning af et terapeutisk antistof, der i øjeblikket testes i kliniske forsøg med IgE-molekylet. Dette terapeutiske antistof, som er af en anden type end IgE, binder sig til IgE og forhindrer derved allergiske reaktioner.
”Vores nye resultater beskriver de strukturelle ændringer, som IgE gennemgår, når det neutraliseres med dette anti-IgE-antistof. Det giver os mulighed for bedre at forstå, hvordan IgE genkender allergener og de to IgE-receptorer, der sidder på overfladen af de immunceller, vi har i vores krop,” lyder det fra lektor ved Institut for Ingeniørvidenskab, Aarhus Universitet, Edzard Spillner.
Antistoffunktioner skal revideres
Generelt producerer en person med allergi høje niveauer af IgE-molekyler rettet mod allergifremkaldende stoffer (kaldet allergener). Disse IgE antistoffer cirkulerer i blodet og binder sig til immunsystemets effektorceller. Når personen udsættes for allergener, bliver de immunceller, som binder IgE, aktive og frigiver store mængder af stoffer kaldet mediatorer og histamin og forårsager derved den allergiske reaktion.
”Men vi er nu klar over, at det billede, vi og andre forskere har stykket sammen gennem årtier ved at studere fragmenter af IgE, skal korrigeres som følge af de nye resultater, vi har opnået med intakt IgE. Og det har været meget tilfredsstillende at kunne visualisere, hvordan anti-IgE-antistoffet påvirker strukturen af IgE og dets antigenbindende arme,” siger professor ved Institut for Molekylærbiologi og Genetik Gregers Rom Andersen.
De nye eksperimenter er udført med forskellige rekombinante IgE-molekyler, som er blevet produceret i laboratoriet. Disse IgE-molekyler genkender specifikt et særligt husstøvmide-allergen samt sukkergrupper fundet på allergener. Men metoden kan overføres til stort set alle andre IgE-molekyler.
Håb om bedre medicin
Over en milliard mennesker verden over er påvirket af allergi, men tallet forventes at stige til fire milliarder i 2050. Det er særligt i forbindelse med miljø- og livsstilsændringer grundet urbanisering og globalisering, at udbredelsen af allergiske sygdomme og deres socioøkonomiske påvirkning er stigende.
Ud over de individuelle lidelser hos enkelte patienter, er allergiske sygdomme omkostningstunge for sundhedsvæsenet. Aktuelle behandlingstilbud kan ikke kontrollere alle typer allergi, men forskerne håber på baggrund af de nye videnskabelige resultater at bane vejen for udviklingen af nye typer allergimedicin.
”Vi har nu en langt bedre og mere detaljeret forståelse af det IgE-molekyle, som vi gerne vil kunne kontrollere, og hvordan det opfører sig ved behandling af patienter med visse typer af allergimedicin. Det giver os mulighed for at opstille nye strategier for, hvordan vi udvikler fremtidens medicin,” siger Edzard Spillner.
Mens den ny viden i sidste ende måske kommer den enkelte patient til gode, vil forskerteamet også udvide den igangværende forskning på området.
”Vi har vist, at IgE besidder nogle usædvanlige egenskaber, som gør det til et spændende objekt for mere detaljerede videnskabelige forsøg, der kan vise, hvordan IgE virker i samspil med andre molekyler involveret i allergiske reaktioner,” forklarer Gregers Rom Andersen.
Set i et større perspektiv giver de nye resultater grundlæggende ny viden om vores immunsystem og danner et udgangspunkt for yderligere forskning. Forskningen blev støttet af Novo Nordisk Fonden.